HOME
当下新冠肺炎疫情席卷全球,疫情肆虐期间,在没有特效药的情况下,干细胞治疗在重大危重病例救助中充当了重要角色。
那么,相信大家肯定会有这样的疑问,到底能否通过静脉注射间充质干细胞来治疗疾病呢,以及为什么能够通过静脉注射间充质干细胞来治疗疾病呢?
今天,为大家解答这一疑问。
首先,答案是肯定的。间充质干细胞(MSC)不仅可以穿透血脑屏障,而且还可以作为一种输送工具,可直接针对患病部位进行治疗,以治疗广泛的疾病。
01MSC的黏附特性
MSC表达广泛的细胞因子和趋化因子受体,使MSC能够对变化的微环境做出快速反应。但是外周静脉输入MSC后,大部分的MSC滞留在肺部,然后随着血流达到肝脏、肾脏、脾脏。虽然外周静脉输入的MSC大部分在肺部滞留并被清除,但是MSC可以被肺部局部的微环境所激活,分泌大量的抗炎因子TSG-6,有利于减轻炎症和减少心梗缺血区的面积。
不同的制备方法可减轻静脉给药MSC的肺滞留。注射MSC重新悬浮在VLA-4的抑制剂肝素中,在体外最大限度地减少了与内皮细胞的粘附。类似地,用抗CD49d抗体预处理以淬灭内源性VLA-4也减少MSC与肺内皮细胞的结合,而用于获取培养的MSC的酶也可以改变了MSC与肺组织的粘附。有研究利用MSC的趋化和迁移特性,并增强MSC对靶器官的归巢。研究表明,IL-8、MCP-1和SDF1mRNA的升高吸引MSC到肿瘤部位。
02MSC穿越血脑屏障(BBB)
血脑屏障(BBB)是一种高度选择性的半渗透边界,它将血液与脑和中枢神经系统(CNS)的细胞外液分开。血脑屏障是由毛细血管壁的内皮细胞、周细胞、星形胶质细胞在毛细血管中形成的。
这个系统允许水、一些气体(O2、CO2)和脂溶性分子(激素)通过被动扩散穿过毛细管基底膜,但会限制病原体的通过,限制血液中溶质的扩散,限制大分子或亲水分子进入脑脊液(CSF)。构成血脑屏障的细胞利用特定的运输通道主动运输对神经功能至关重要的分子如葡萄糖和氨基酸,还有代谢产物。
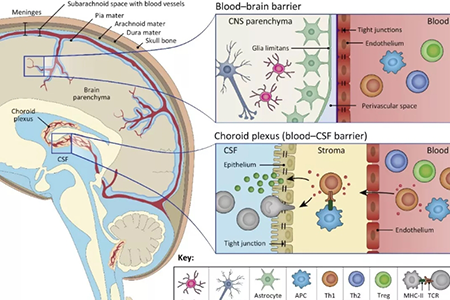
颅脑创伤能引起血脑屏障的通透性增强。血脑屏障的通透性增强很可能是大脑创伤后出现癫痫的重要机制。在损伤、炎症和衰老期间,血脑屏障的紧密连接也会受到损害。这个病理性变化,非常有利于MSC外周血管输入治疗颅脑损伤性疾病,而不需要创伤性地定位脑部微注射。
让人惊讶的是,MSC可以在没有帮助的情况下穿越BBB,特别是在MSC可以参与维持BBB的情况下。MSC有很强的穿透血管的能力,比如建立皮肤炎症的小鼠模型,给与静脉注射MSC,观察到约47.8%的MSC在2小时后就穿过血管壁进入肌肉组织。
MSC可能采用类似白细胞与内皮细胞接触的方式(即滚动、粘附和迁移)穿过血脑屏障,尤其是存在炎症因子对内皮细胞有损伤的情况下。
但是MSC在人脐静脉内皮细胞上的滚动速度为明显高于白细胞的滚动速度。MSC表达多种趋化因子受体和细胞粘附分子(如CD44、CD99等),但缺乏一些关键的内皮细胞选择素的配体,包括P-选择素糖蛋白配体1(PSGL-1)、LFA-1和Mac-1。有研究显示MSC并不表达E-选择素配体,而是通过CD44糖型转化后结合E-选择素来趋化迁移。MSC可以通过VCAM-1/VLA-4与内细胞相互作用,参与MSC在内皮细胞上的粘附和迁移。MSC与内皮细胞通过黏附分子结合后,则通过伪足来爬行、扩散和延伸。
虽然体外实验发现血液流动速度影响MSC和内皮细胞的相互作用。比如在连续流动条件下,MSC与内皮细胞缺乏相互作用;当血流停止(10分钟)然后启动时,MSC粘附并爬行于内皮细胞表面,延伸出细小的微绒毛突起(丝状足突)。CXCL9、CXCL16、CCL20和CCL25可显著提高MSC的贴壁率,促进MAEC的跨内皮细胞迁移。但是,活体动物不存在血流停止10分钟的情况,MSC输入活体动物后,MSC依然能穿过血管,到达血管外的区域。
有意思的是,bFGF、VEGF、EPO和IL-6存在的情况下共培养MSC可以显著增加MSC与单层内皮细胞的整合;VEGF、EPO和IL-6促进了MSC的迁移,而bFGF显著降低了MSC的迁移。MMPs-TIMPs的激活和平衡也与MSC跨内皮细胞迁移有关,这为MSC在体内归巢和外渗到受损组织提供了一个潜在的机制。MSC的高融合培养还可以增加内源性TIMP-3的产生,减弱MSC的跨内皮迁移能力。
应该注意的是,无论MSC是从不同的组织来源分离的,不同的培养方式,暴露在不同的细胞因子提示下,还是仅仅包含不同的异质群体,MSC的归巢能力可能已经改变。因此,不管MSC迁移到大脑的具体机制如何,BBB通透性(无论是炎症还是药物诱导),再加上炎症区域的细胞因子梯度,都会增加MSC向大脑受伤区域的迁移。
03MSC作为神经营养因子及来源
无论是急性还是慢性,各种原因(创伤性、炎症性或缺氧性)导致的神经损伤之后,神经组织不能完全自我修复。体外诱导分化实验证明MSC具有分化为功能性神经元的能力。而且MSC进入体内后,智能地趋化到几乎所有炎症部位,比如骨折、炎性肠炎、心肌梗死和肿瘤,甚至包括脑部胶质瘤。
外源性MSC很少停留在靶器官中,其修复的机制包括释放可溶性因子、神经营养因子和微泡(MV)。通过这些方式,MSC减少炎症和随后进一步的组织损伤,并促进组织修复和再生。MSC采用多种细胞间通讯方式,包括直接细胞通讯的缝隙连接通讯(GJIC),间接通讯的释放MV和可溶性因子等。在GJIC中,在两个细胞的细胞质之间形成了一个直接通道,包括miRNA在内的小分子可以通过该通道向靶细胞发送调节信号。MSC还释放大量含有RNA和蛋白质的MV,包括外泌体,它们也可以作用于靶细胞,以旁分泌和内分泌的方式调节细胞功能。MSC发挥了神经营养和神经再生的作用是通过其分泌物,包括它们的外泌体和其他微囊,而不是通过细胞替换。
04总结
通过全身给药的MSC在治疗多种神经和脑部疾病方面具有巨大的潜力。这在很大程度上是因为它们能够穿越同种异体屏障和血脑屏障,抗炎特性和聚集炎症区域的能力,以及MSC的分泌体和释放的微囊。然而,影响到MSC疗效的因素实在是太多了,MSC的趋化和迁移只是其中一个方面。